Vaccino anti-Covid. Ecco perché lo abbiamo ottenuto in 10 mesi. Le fasi
Una delle perplessità inerenti il vaccino Anti-Covid, che alimenta la parte negazionista del Paese, e che alimenta un certo scetticismo, riguarda i tempi di sperimentazione del vaccino Pfizer, ritenuti dalla frangia oppositiva troppo brevi rispetto alla normale messa in commercio di altri comuni vaccini.
Ma davvero il percorso breve del vaccino Anti Covid, ha sacrificato fasi fondamentali per sicurezza ed efficacia?
In una nota il direttore generale dell’Agenzia italiana del Farmaco (Aifa), Nicola Magrini, ha definito “sbagliato diffondere affermazioni infondate sulla sicurezza” del vaccino anti Covid. Quella “più grave, in quanto falsa, riguarda le fasi degli studi clinici che potrebbero essere state saltate. Gli studi clinici sui vaccini anti Covid-19 hanno effettuato tutte le fasi di validazione e valutazione”.
Che cos’è un trial clinico?
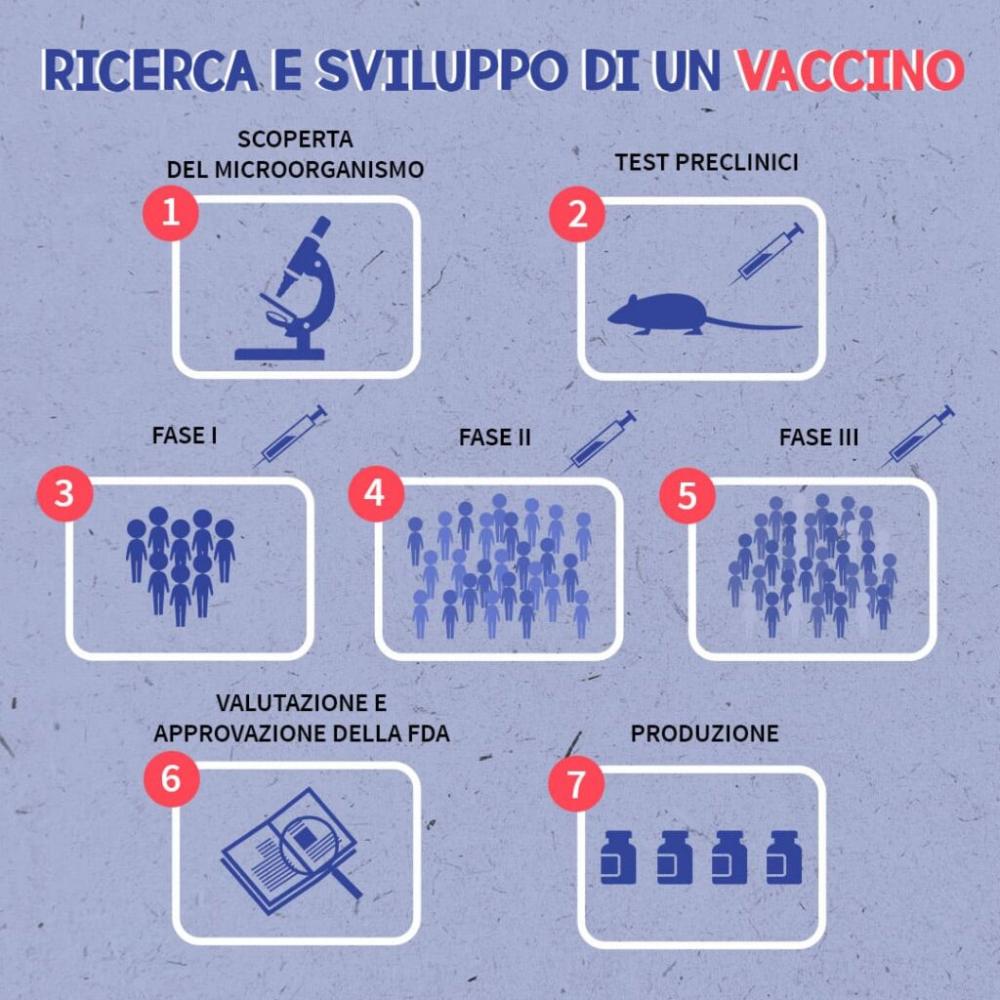
Si definisce Trial Clinico la sperimentazione di un trattamento (farmacologico o vaccinale) tesa a verificare se, per efficacia e sicurezza, il prodotto sia idoneo all’uso nell’uomo. In un trial clinico il prodotto in studio viene somministrato sotto stretto controllo medico, al fine di osservare se esso può essere nocivo, se ha o meno effetti collaterali, se è efficace e in quale misura lo sia, nel contrastare o prevenire l’insorgenza della malattia che ne costituisce l’indicazione nonché quali siano i dosaggi e i regimi di trattamento più adeguati. La sperimentazione clinica di un nuovo prodotto farmaceutico (farmaco o vaccino) consta di 3 fasi successive, definite convenzionalmente fasi I, II e III.
La fase clinica della sperimentazione è sempre preceduta da una fase, detta pre-clinica, con la quale prima della somministrazione all’uomo il trattamento viene testato in laboratorio (anche su modello animale) al fine di approfondirne la conoscenza dei profili chimico, fisico e farmacologico e di valutare di conseguenza l’opportunità di procedere al delicato passaggio dell’assunzione della sostanza stessa da parte dell’uomo.
Cosa significa trial di fase I?
Una sperimentazione clinica di fase I prevede la prima assunzione del prodotto farmaceutico sperimentale da parte dell’uomo. Essa si esegue su un numero esiguo di volontari, sani e/o affetti dalla patologia che rappresenta la teorica indicazione preventiva o terapeutica del prodotto in studio. L’obiettivo primario di questi studi è la valutazione della tollerabilità e sicurezza del prodotto stesso sull’uomo.
Cosa significa trial di fase II?
Una sperimentazione clinica di fase II viene avviata solo se la precedente fase I ha prodotto risultati soddisfacenti, cioè se essa ha confermato l’innocuità del trattamento. Il numero di partecipanti previsti è solitamente basso, benché maggiore rispetto alla fase I. Gli studi di fase II hanno come obiettivo primario la valutazione della risposta immune indotta dal trattamento pur non trascurando gli aspetti legati alla tollerabilità e sicurezza del prodotto. Nel caso di un vaccino il risultato di questa fase sperimentale indica se il trattamento proposto sia immunologicamente efficace e, in caso affermativo, quali siano le dosi e i protocolli di somministrazione più adeguati
Cosa significa trial di fase III?
Se gli studi delle precedenti fasi I e II hanno avuto esito positivo, si procede alla cosiddetta fase III, in cui il prodotto in studio viene somministrato ad un numero assai più elevato di pazienti (migliaia), nella posologia e nella forma farmaceutica definite con gli studi precedenti. Le maggiori dimensioni del campione consentono di completare le informazioni raccolte nel corso della fase II e di identificare reazioni avverse al farmaco più rare di quelle già note. Questa è la fase più estensiva di tutto il processo, quella con cui ci si propone di dimostrare il vantaggio preventivo o terapeutico ascrivibile al prodotto in esame. Gli studi di fase III possono anche essere intrapresi per studiare nuove indicazioni o nuovi dosaggi terapeutici di farmaci già in commercio ovvero per testare associazioni fra più trattamenti per le quali è possibile prevedere un effetto sinergico con conseguente miglioramento dell’efficacia terapeutica complessiva. In caso di esito positivo, è possibile procedere alla registrazione per la distribuzione su vasta scala del prodotto farmaceutico sperimentato.
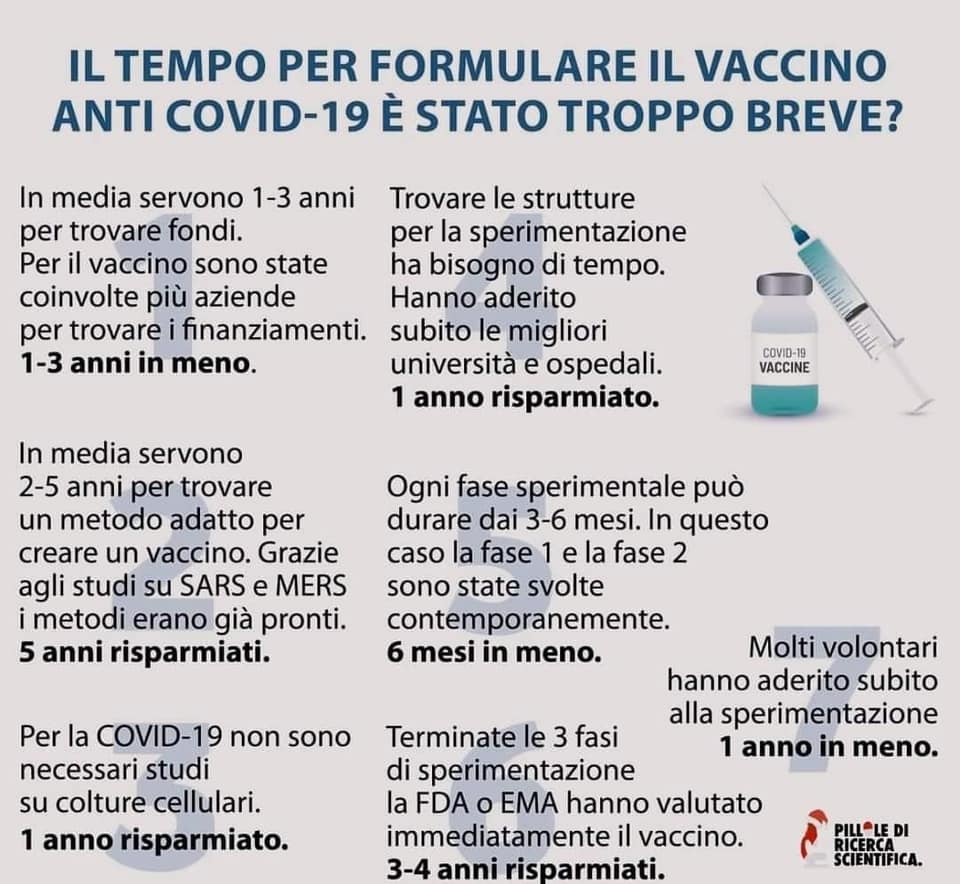
Cosa ha abbreviato il percorso del vaccino?
Innanzitutto la ricerca dei fondi finanziari è stata celere, il coinvolgimento delle aziende è stato ampio, risparmiando così i due- tre anni di media per lo stanziamento economico fondamentale.
Per trovare le strutture per la sperimentazione, solitamente il tempo impiegato è di un anno. Data l’importanza del vaccino, utile al contrasto di una pandemia devastante, alla sperimentazione hanno aderito subito le migliori università ed ospedali.
Veniamo alle fasi di sperimentazione, I e II: le due fasi possono durare ognuna dai tre ai 6 mesi ciascuna; in questo caso entrambe sono state svolte contemporaneamente.
Per quanto riguarda il metodo utilizzato, l’mRNA, questo metodo era già noto ai ricercatori grazie agli studi condotti in precedenza su SARS e MERS. Questo ha contribuito ad abbreviare i tempi, permettendo ai ricercatori di accorciare questo processo di circa 5 anni.
Il fatto che questa tecnologia non debba essere studiata su colture cellulari, in quanto fase non necessaria per il Covid-19, ha abbreviato i tempi di un anno.
La ricerca dei volontari. Grazie ad una adesione massiccia, il tempo risparmiato è stato di un anno. Solitamente per la valutazione dell’efficacia di un vaccino sono richiesti dai 300 ai 3000 partecipanti: Pfizer ne ha reclutati 50 mila e 30 mila Moderna.
Infine, terminate le tre fasi di sperimentazione, FDA ed EMA, hanno valutato subito i dati forniti dalle aziende farmaceutiche. Il vaccino Covid ha avuto la precedenza rispetto ad altri farmaci in sperimentazione. Questo passaggio ha permesso di risparmiare 3-4 anni.
L’intero processo ha subito quindi un accelerazione nei processi burocratici, ma non in rigore e valutazione di efficacia e sicurezza.
European Medicines Agency. COVID-19 vaccines: development, evaluation, approval and monitoring
ISS
credit photo: https://www.thedifferentgroup.com/

 di
di